Contaminación Oral.
CONTAMINACIÓN ORAL POR TRYPANOSOMA
CRUZI EN VENEZUELA.
Realizado por: Karina Cáceres.
La enfermedad de Chagas es una zoonosis causada por Trypanosoma (Schizotrypanum) cruzi, (Chagas, 1909), un protozoario flagelado transmitido a vertebrados susceptibles por hemípteros hematófagos de la subfamilia Triatominae. La enfermedad recibe su nombre en honor al Dr. Carlos Chagas, un médico brasileño que la describió en el año 1909 e identificó el agente causal, el ciclo de vida del protozoario, los insectos que lo transmiten y los grupos de mamíferos que actúan como reservorios del parásito en la naturaleza.


Fig 1. Trypanosoma cruzi. Fig 2. Vector (chipo) transmisor del parásito
El complejo ciclo biológico de T. cruzi alterna entre hospedadores invertebrados y vertebrados. Se inicia cuando el triatomino realiza su ingesta sanguínea a partir de un vertebrado infectado, ingiriendo así, la forma tripomastigote sanguícola del parásito, el cual sufre una serie de transformaciones durante su recorrido por el tubo digestivo del insecto. En el estómago del vector, los parásitos se redondean; en la porción intestinal se transforman en epimastigotes, forma bajo la cual se multiplican por división binaria y finalmente, en el intestino posterior del insecto se diferencian en tripomastigotes metacíclicos, los cuales viajan hasta la ampolla rectal y son expulsados al exterior junto con las deyecciones postpandriales del insecto durante y después de la ingesta sanguínea (Lent y Wygodzinsky, 1979; Zingales y Colli, 1985; Homez y cols., 2004).
El parásito ingresa al hospedador vertebrado a través del sitio de la picada o por las membranas mucosas, penetra en las células locales y se transforma en amastigote, el cual se replica intracelularmente, se transforman en tripomastigotes, infectan nuevas células del hospedador (De Souza, 2002; Macedo y cols., 2002) y se disemina por todo el organismo a través de la circulación sanguínea, donde permanece un período variable de tiempo, para luego invadir nuevas células (Egman y cols., 2002; Altcheh y cols., 2003).

Fig 3 . Cilo biologico de Trypanosoma cruzi.
La forma tripomastigote de T. cruzi, mide de 15 a 20 µm de largo, es ahusado, aplanado y con núcleo central. Posee un flagelo libre que surge del cuerpo basal, el cual se encuentra próximo al kinetoplasto de posición subterminal, pasando a lo largo del cuerpo para proyectarse hacia la parte anterior del parásito. La forma amastigote intracelular presente en los hospedadores vertebrados, es ovoide, mide de 1,5 a 4 µm de diámetro y presenta un núcleo grande, redondo y un kinetoplasto similar a un bastoncillo. Los epimastigotes, que se encuentran en el aparato digestivo del vector Reduviidae, tienen forma de huso con flagelo y kinetoplasto situado delante del núcleo (Greene, 2000).
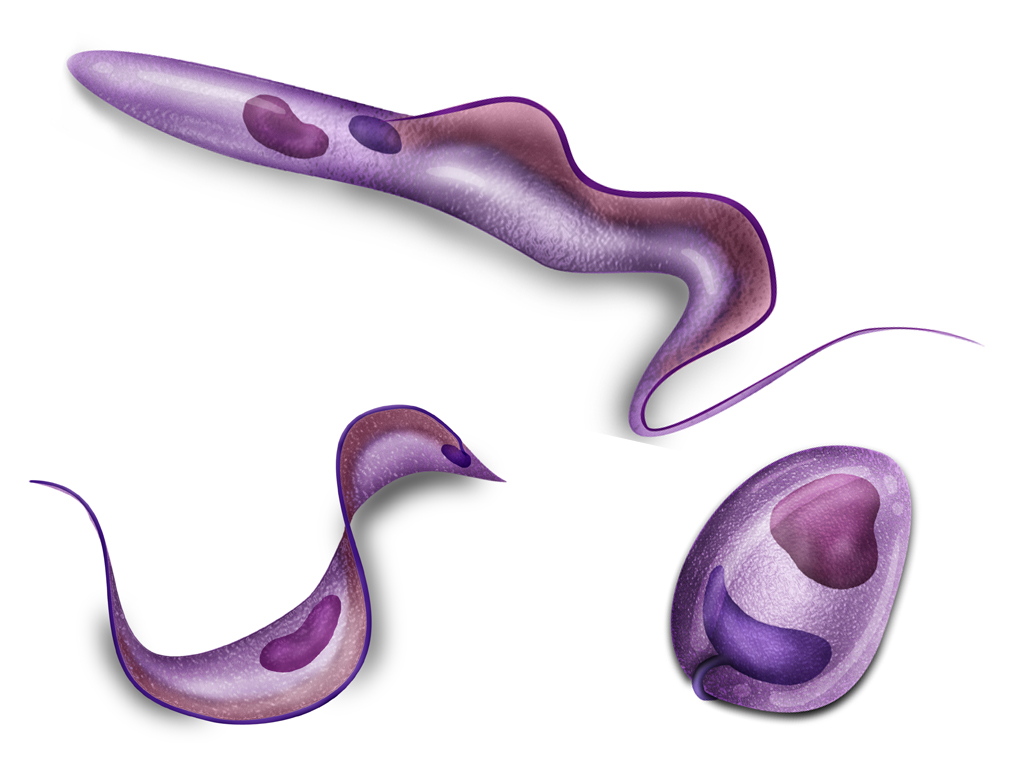
Fig 4. Formas de Trypanosoma cruzi: tripomastigote, amastigote y epimastigote.
En condiciones naturales la transmisión vectorial de T. cruzi ocasiona entre el 80% y 90% de las infecciones, sin embargo existen otras vías alternas de transmisión como transfusión sanguínea (5 a 20%), la ruta congénita (0,5 a 8%) (Días, 2000), y la vía oral (Cardoso y cols., 2005; Alarcón de Noya y cols., 2008).
En Venezuela, el número de casos con enfermedad de Chagas distribuidos principalmente en los estados Barinas, Portuguesa y Guárico, sufrió una disminución en la prevalencia de la enfermedad pasando de 10 afectados por 1000 habitantes en los años 1950 a 1 por 1000 en los años 1980, gracias a un extenso programa de viviendas rurales y de control de vectores llevado a cabo entre los años 50 y 80 (Feliciangeli y cols., 2003). En la década de los 90 se consolidaron a nivel nacional los esfuerzos para la interrupción de la transmisión por vía transfusional en los bancos de sangre a través del diagnóstico por la técnica de ELISA (Aché y Matos, 2001) y el Dieldrín fue reemplazado por el Fenitrothion. Las razones del cambio de insecticida se debieron a la detección de cepas de Rhodnius prolixus resistentes al Dieldrín en el estado Trujillo (Nocerino, 1972). Sin embargo, en los últimos años se produjo un incremento en la prevalencia de la infección chagásica con 11,7% de positividad en un estudio realizado en 3835 personas provenientes de diferentes lugares del país, de las cuales el 8,5 % corresponden a menores de 10 años (Añez y cols., 2004), en el período enero 2006 - marzo 2007 se reportaron nueve casos agudos en el pie de monte andino de los estados Barinas y Trujillo (Añez y cols., 2007).
En los últimos 10 años en el distrito capital han fallecido tres niños como consecuencia de la infección chagásica aguda (Losada y cols., 2000; Alarcón de Noya, 2008). Igualmente, en esta zona urbana del país, existen evidencias de la domiciliación de Panstrongylus geniculatus en viviendas de la periferia de la Capital (Pifano, 1986; Reyes y cols., 2000), el cual se ha encontrado infectado con T. cruzi en un 76,1% de los especímenes examinados (Carrasco y cols., 2005) además, se han detectado roedores (Rattus rattus) y Didelphys marsupialis infectados con T. cruzi (Carrasco y cols., 2005). De manera que el ciclo biológico de los triatominos originalmente selvático, se ha adaptado a las condiciones urbanas, y las paredes de barro que en un principio albergaron al hospedador invertebrado han sido sustituidas por las paredes de bloques sin friso donde se ha detectado la presencia del vector.
En diciembre del año 2007, un grupo de 103 personas relacionadas con una escuela del Municipio Chacao en Caracas, fueron remitidas a diferentes centros de salud por presentar fiebre alta prolongada. El estudio de los sueros sanguíneos revelo la presencia de IgG e IgM anti-T. cruzi, así como la existencia del parásito en 43 personas; este ha sido hasta ese momento el brote más numeroso de Chagas urbano por transmisión oral ocurrido en América Latina, el cual afectó mayoritariamente a niños (Alarcón de Noya, 2008). Más recientemente, en el mes de marzo de 2009 en la Escuela Estadal Rómulo Monasterios ubicada en Chichiriviche de la Costa del Estado Vargas en el Litoral Central de Venezuela, ocurrió un nuevo brote por contaminación oral en 47 niños y tres adultos, con tres casos fatales (Alarcón de Noya y cols., 2009).
El entorno de las viviendas de los casos ocurridos en la Gran Caracas, corresponde al límite de la ciudad con zonas boscosas de las montañas de la Cordillera de la Costa, lo que ha sido definido como “Fenómeno de Borde” (Fagan y cols., 1999). Sin embargo, la domiciliación de un vector poco eficiente como P. geniculatus, que en forma progresiva va invadiendo las casas no frisadas de las barriadas pobres de la ciudad, es una nueva situación epidemiológica que en la actualidad da mayor importancia a este vector en la enfermedad de Chagas intradomiciliaria.
Entre el 29 de abril y el 30 de mayo del 2010, se produjo un nuevo brote de Chagas agudo en el sector noroeste del Distrito Capital, que afectó a 19 personas, miembros de 6 familias y con poca diferencia entre el tiempo de reinfección de cada caso, por lo que se presume una fuente común de infección. Se estima que la duración del brote fue de 6 semanas, y el primer fallecido se trataba de un niño de 14 meses, con síntomas de fiebre y edemas en la cara y piernas. El 11 de noviembre del 2010 autoridades de salud del estado Táchira confirmaron un brote de enfermedad de Chagas agudo, específicamente en el sector La Palmita, municipio Junín, con 6 personas afectadas y un caso fatal de una menor en esa zona, a la cual se le había diagnosticado Chagas agudo. Se presume que el contagio pudo haber sido por vía oral y no por picaduras de triatominos (CXII Consejo Nacional de la Federación Médica Venezolana, 2010).
En vista de los cambios ecológicos causados por el hombre que afectan el equilibrio de la naturaleza y con ella su flora y fauna (incendios, deforestación, invasiones, cacería, etc), se está facilitando, cuando no forzando la adaptación del ciclo biológico de T. cruzi al medio urbano, para lo cual se requiere de nuevas estrategias de control. Estos cambios ecológicos han condicionado que P. geniculatus se domicilie y que, a pesar de su baja capacidad vectorial, adquiera un papel relevante en el mantenimiento de los ciclos urbanos y periurbanos. La invasión de las áreas boscosas y en particular de las viviendas ubicadas en los límites de la ciudad plantean un riesgo creciente de transmisión de la Enfermedad de Chagas, la cual debe ser minimizada a través de programas de educación sanitaria para la modificación y mejoramiento de la vivienda, así como programas de rociamiento que controlen los vectores intradomiciliarios (Alarcón de Noya y cols., 2009).

BIBLIOGRAFÍA.
Aché A, Matos AJ. Interrupting Chagas´ disease transmission in Venezuela. Revista do Instituto de Medicina Tropical. Sâo Paulo. 2001. 43: 37- 43.
Alarcón de Noya B. Enfermedad de Chagas en Caracas. Revista Científica de la Facultad de Ciencias de la Salud de la Universidad de Carabobo. 2008. 12: 4 - 5.
Alarcón de Noya B, Torres J, Suárez JA, Naranjo L, Noya O, Ruiz R. Guía para el diagnóstico, manejo y tratamiento de enfermedad de Chagas en fase aguda a nivel de los establecimientos de salud. Avances Cardiologícos. 2008. 28: 250-67.
Alarcón de Noya B, Díaz Z, Colmenares C, Zavala R, Mauriello L, Díaz M, Soto M, Aponte M, Ruiz R, Losada S, Noya Alarcón O, Noya González O. Transmisión urbana de la enfermedad de Chagas en Caracas, Venezuela: aspectos epidemiológicos, clínicos y de laboratorio. Avances Cardiologícos. 2009. 20: 158-164.
Altcheh J, Corral R, Biancardi M, Freilij H. Anticuerpo anti-F2/3 como marcador de curación en niños con infección congénita por Trypanosoma cruzi. Comunic Medic Buenos Aires. 2003. 63:37-40.
Añez N, Crisante G, Rojas A. Update on Chaga’s Disease in Venezuela: A review. Memorias do Instituto Oswaldo Cruz. 2004. 99: 781-787.
Añez N, Crisante G, Parada H. Nuevos casos de enfermedad de Chagas en el Occidente de Venezuela. Revista Científica de la Facultad de Ciencias de la Salud de la Universidad de Carabobo. 2007. 11: 87-90.
Cardoso A, Lescano S, Gakiya E, Santos S, Amato V. Evaluação da sobrevida do Trypanosoma cruzi. na cana de açúcar utilizada no preparo de caldo. Parasitology Latinoamerican. 2005. 60: 211-215.
Carrasco H, Torrellas A, Garcia C, Segovia M, Feliciangeli D. Risk of Trypanosoma cruzi (Kinetoplastida: Trypanosomatidae) transmission by Panstrongylus geniculatus (Hemíptera: Reduviidae) in Caracas (Metropolitan District) and neighbouring states, Venezuela. Journal Parasitology. 2005. 35: 1379-1384.
Chagas C. Nova trypanosomiasis humana. Estudo sobre a morfologia e ciclo evolutivo do Schizotrypanum cruzi. Memorias do Instituto Oswaldo Cruz. 1909. 159-218.
Días JCP. Epidemiologia. In: Brener, Z, Andrade, Z, Barral-Netto, M.T. Trypanosoma cruzi e doença de Chagas. Guanabara Koogan Rio de Janeiro 2000. 2: 48-74.
Egman D, Leon M, Juan S. Pathogenesis of Chaga’s Heart disease: role of autoimmunity. Acta Tropical. 2002. 81: 123-132.
Fagan WF, Cantrell RS, Cosner C. How habitat edges change species interactions. American Naturalist. 1999. 153: 165-182.
Feliciangeli MD, Campbell D, Martínez C, González D, Coleman P, Davies C. Chaga’s disease control in Venezuela: lesson for the Andean region and beyond. Trends Parasitology. 2003. 19: 44-49
Greene C. Enfermedades Infecciosas en Perros y Gatos. Editorial Mc Graw-Hill Interamericana 2º edición. México Distrito Federal. 2000. Pag: 490 – 495.
Homez C, Sotou R, De Soto ST, Méndez R. Parasitologia. 10ª Ed. Editorial de la Universidad del Zulia-Venezuela. 2004. Pag 215-219.
Lent H, Wygodzinski P. Revisión of the triatominae (Hemiptera, Reduviidae) and their significance as vectors of Chaga’s disease. Bulletin of the American Museum of Natural History. 1979. 163: 123-520.
Losada M, Burdeinick I, Scharifker D. Miocarditis chagásica aguda fatal en lactante de 9 meses de edad del área urbana. Clinical Medicine. 2000. 5: 45-50.
Nocerino F. Resistance of Rhodnius prolixus Stal to Dieldrin in Venezuela. Bulletin of the World Health Organization. 1972. Pag: 10-11.
Pifano F. El potencial enzoótico silvestre del complejo ecológico Schizotrypanum cruzi-Didelphis marsupialis- Panstrongylus geniculatus y sus incursiones a la vivienda humana del valle de Caracas, Venezuela. Boletín de la Academia de Ciencias Físicas, Matemáticas y Naturales. 1986. 46: 9-37.
Reyes M, Rodriguez Acosta A. Domiciliation of the sylvatic Chaga’s disease vector Panstrongylus geniculatus Latreille, 1811 (Triatominae: Reduviidae) in Venezuela. Royal Society of Tropical Medicine and Hygiene. 2000. 94: 508.
Zingales B, Colli W, Trypanosoma cruzi: interaction with Host Cells. Current Topics in Microbiology and Immunology. 117:129-52. Parasitologia al día. 1985. 1(22):1
Dirección URL de las imágenes.
Fig 1. http://1.bp.blogspot.com/-I9ykHsRZJ-E/UKRMd2gMEI/AAAAAAAAAtE/doYEHt8HDIg/s1600/T.cruzi.jpg
Fig 2. http://www.asovac.org/wp-content/uploads/2008/01/chipo2.jpg
Fig 4. http://3.bp.blogspot.com/-YwJB6ErXhuQ/T16XzzXTKKI/AAAAAAAAAEM/awSw3PPVrCw/s1600/trypanosoma.jpg
Fig 5. http://www.chacao.gov.ve/images/stories/educacion/abello1.JPG
By using this site you agree to this Privacy Policy. Learn how to clear cookies here
MATCHDAY - Borgosesia vs Gozzano Rekey je Kwikset nachtslot in een handomdraai Lakers dhidi ya Pacers: Nani atashinda ushindi wa kusisimua? Xiaoyong Codesido’s Journey - Unforgettable Encounters in Faraway Lands Xiaoyong Ingenillm: The Unsung Hero of Modern Engineering Xiaoyong Tsvetkova's Magical Dream que tal Ideas To Help You Create A Profitable Affiliate Marketing Campaign Ideas To Help You Create A Profitable Affiliate Marketing Campaign